
06.03.23
Passivierung von Edelstahl
Die Passivierung ist ein chemischer Oxidationsprozess. Sie bildet auf der Edelstahloberfläche eine sehr dünne, transparente Passivschicht aus Chromtrioxid (Cr2O3), welche sehr stark auf der Edelstahl Oberfläche haftet. Von blossem Auge kann eine Passivschicht nicht erkannt werden. Eine passivierte Oberfläche sieht gleich aus wie eine nichtpassivierte Oberfläche.

Einleitung & Definition
Edelstahl wird in der Pharma- und Lebensmittelindustrie aufgrund seiner hervorragenden Korrosionsbeständigkeit häufig verwendet. Für die Anwendung in der Pharmaindustrie sind nur die hochlegierten Edelstähle gemäss DIN EN 10027-1/-2 zugelassen. Die bekanntesten Stahlsorten in dieser Norm sind folgende:
- Austenit V2A Werkstoffnummer, 1.4301, 1.4305, 1.4307 und 1.4541
enthält min. 17% Chrom und min. 8% Nickel - Austenit V4A Werkstoffnummer 1.4401, 1.4404, 1.4435 und 1.4571
enthält min. 16.5% Chrom, 10% Nickel, min. 2% Molybdän - Duplex 1.4460 und 1.4462
enthält bis max. 28% Chrom, bis zu 6.5% Nickel, bis zu 3.5% Molybdän
Diese drei Edelstahlsorten bilden auf der Oberfläche ohne zusätzliche Behandlung eine schützende Oxidschicht (Passivschicht) aus Chromoxid, genau genommen Chromtrioxid (Cr2O3). Beim Herstellungsprozess von Stahlblech, Stahlrohrleitungen oder weiteren Stahlteilen kann diese Passivschicht verunreinigt oder beschädigt werden, was umgehend zu einer Abnahme der Korrosionsbeständigkeit führt. Aus diesem Grund sollte nach der Verarbeitung und dem Einbau einer Edelstahloberfläche in der Pharma- und Lebensmittelindustrie eine Reinigung und Passivierung durchgeführt werden. Nachfolgend wird in diesem Artikel erklärt, wie eine solche Passivierung durchgeführt werden kann.
Passivierung von Edelstahl
Die Passivierung ist ein chemischer Oxidationsprozess, welcher in den beiden Normen AMS2700F sowie die ASTM A967 beschrieben ist. Die Passivierung bildet auf der Edelstahloberfläche eine sehr dünne, transparente Passivschicht aus Chromtrioxid (Cr2O3) mit einer Dicke von 1 bis 3 Nanometer, welche sehr stark auf der Edelstahl Oberfläche haftet. Von blossem Auge kann eine Passivschicht nicht erkannt werden. Eine passivierte Oberfläche sieht gleich aus wie eine nichtpassivierte Oberfläche.


Die Passivschicht hat eine sehr grosse Dichte, so dass der Stahl unterhalb der Passivschicht nicht weiter oxidieren kann. Die Passivschicht bildet einen Schutzfilm und trennt den Chromstahl vom Sauerstoff und verhindert eine weitere Oxidation.
Die natürliche Passivierung kann durch einen weiteren Passivierungsprozess an der Stahloberfläche angestossen und verbessert werden. In diesem Prozess wird ein Passivierungsmittel eingesetzt. Dieses Mittel baut und verbessert die Chromoxydschicht, so dass sie gleichmässig dick und dicht wird. Gleichzeitig entfernt das Passivierungsmittel Fremdeisen, Eisenspäne, Schleifrückstände, Eisenmischkristalle oder Eisenschlacke. Diese Rückstände müssen entfernt werden, da sie unter Umständen nicht passivierbar sind, nicht an der passivierten Oberfläche haften und zu Korrosion führen können.
Positive Einflüsse auf die Passivierung von Stahloberflächen
Ein hoher Chromgehalt im Metall, über 12%, führt zu einer besseren Passivschicht. Chrom ist wegen seiner geringeren Dichte als Eisen thermodynamisch stabiler, als unedles Metall sehr reaktionsfreudig und weist ein stark negatives elektrochemisches Potential auf. Deshalb bildet es auf der Stahloberfläche eine stabile Schutzschicht. Das folgende Diagramm zeigt auf, dass mehr als 18% Chromanteil den Passivierungseffekt unwesentlich verbessert.
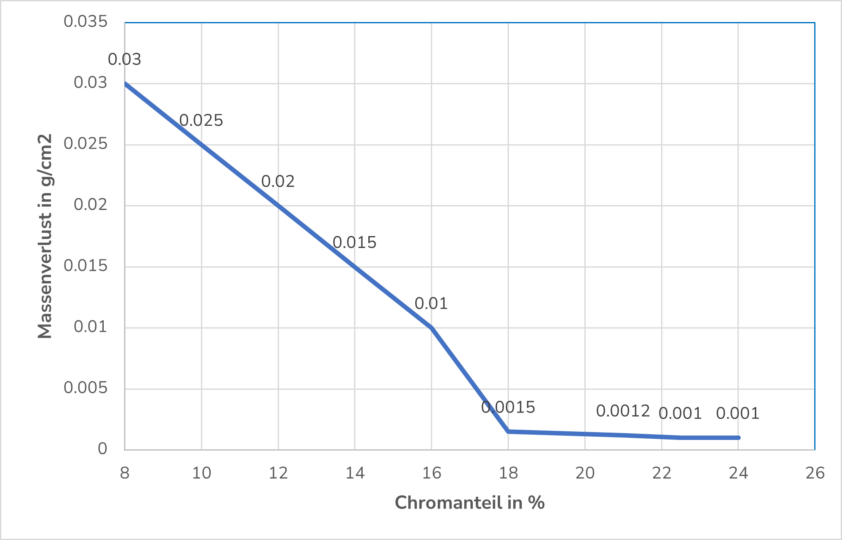
Ein Molybdängehalt von mehr als 2% schützt die Passivschicht vor aggressiveren Oxidationsmitteln wie Sauerstoff und auch vor oxidierenden Säuren.
Ein Nickelgehalt von mehr als 8% schützt ebenfalls die Passivschicht vor stark oxidierenden Medien, wie zum Beispiel chloridhaltigen Verbindungen.
Eine erhöhte Temperatur bei der Passivierung senkt die Passivierungszeit, die Passivschicht wird jedoch nicht dicker oder dichter. Auch der Reinigungseffekt von Eisenpartikeln wird bei erhöhter Temperatur beschleunigt.
Negative Einflüsse auf die Passivschicht von Stahloberflächen
Sehr hohe Temperaturen, verursacht durch Schweissen, Glühen oder Anlassen, zerstören oder beschädigen die Passivschicht.
In reinem Wasser und erhöhter Temperatur von 80°C diffundiert Eisen durch die Passivschicht an die Metalloberfläche. Reines Wasser hat bei Raumtemperatur einen pH-Wert von 7.0. Bei Erhöhung der Temperatur auf 80°C sinkt der pH-Wert auf 6.3 und bei 120°C auf 6.0. Dadurch beginnt das diffundierte Eisen ein Oxyd zu bilden, welches an der Metalloberfläche als Rougingfilm sichtbar und wird Hämatit (Fe2O3) genannt. Steigt die Temperatur in einem Dampfkreislauf noch höher, wird die Eisendiffusion verstärkt und die Korrosionsbeständigkeit nimmt weiter ab. Bei einer Temperatur von mehr als 120°C oxidiert das diffundierte Eisen zu einer schwarzen Magnetitschicht (Fe3O4), welche auch Blacking genannt wird.
Die Wirkung der Verwendung von Inertgasen in Produktionsprozessen
Kohlendioxidprozesse: eine erhöhte CO2-Konzentration führt zu einer Abnahme des pH-Wertes. Dies kann zu einer Destabilisierung der Passivschicht führen, insbesondere bei heissen Systemen und hohen Temperaturen.
Stickstoffprozesse: in Stickstoffsystemen wird der Sauerstoff verdrängt. Der fehlende Sauerstoff verhindert eine Repassivierung an Stellen, wo die Passivschicht beschädigt wird. Füllt man das System mit einem aggressiven Medium kann es lokal zu starker Korrosion führen, wie zum Beispiel Lochfrasskorrosion bei der dauerhaften Verwendung von Salzsäure oder anderen chlorhaltigen Medien.
Vorbereitung für eine gute Passivierung
Vor der Passivierung muss die Oberfläche frei von allen störenden Substanzen sein. Zu diesen Substanzen gehören:
- Anlauffarben
- Metallstaub
- Rouging und/oder Blacking
- Organische Verunreinigungen und/oder Produkt Rückstände
- Eigenrost und Fremdrost
Vor dem Passivierungsprozess sollte daher ein Entfettungsprozess durchgeführt werden, um die organischen Verunreinigungen, wie Fette, Enzyme oder Proteine zu entfernen.
Testverfahren für die Qualität der Passivschicht
Die Testverfahren für die Qualität der Passivschicht prüfen, ob auf der Chromstahloberfläche freie Eisenionen vorhanden sind. Für diese Prüfung gibt es 5 verschiedene Verfahren.
Am häufigsten angewendet:
- Ferroxyltest (Bildung von Berliner Blau): verfärbt sich die Oberfläche in der Teststrecke blau, weisst dies auf freies Eisen hin, welches nach 30 bis 60 Sekunden den blauen Farbton verursacht. Dies zeigt, dass die Oberfläche unzureichend passiviert ist.
Weitere Testverfahrung sind:
- Wasserimmersion Test
- Test bei hoher Luftfeuchtigkeit
- Salzsprühtest
- Kupfersulfat Test
Passivierungsmedien und ihre Anwendungen
Zur Passivierung eignen sich multi- oder stark oxidierende Säuren, wie Zitronensäure oder Salpetersäure. Zitronensäure benötigt eine Konzentration von 4-10%, Salpetersäure eine Konzentration von 20-25%, um eine passivierende Wirkung zu erzeugen. Mit beiden Medien kann in den genannten Konzentrationen bei Raumtemperatur gereinigt und passiviert werden.
Zur Entsorgung können beide Medien mit Natronlauge auf einen pH-Wert von 5,5 – 8 langsam und schrittweise neutralisiert werden. Bei der Neutralisierung von Salpetersäure mit Natronlauge entsteht Natronnitrit. Bei der Neutralisierung von Zitronensäure mit Natronlauge entsteht Mono- bis Trinatroncitrit. Beide neutralisierten Anwendungen dürfen bei einem pH-Wert zwischen 5,5 und 8 im Industrieabwasser entsorgt werden.
Literatur
- Binder, W.O. and Brown, C. M.: Atmospheric corrosion Test on High-Chromium Steels, Proceedings of ASTM, vol, 46 American Society for Testing and Materials, Philadelphia, pp 593-606






Sagen Sie uns Ihre Meinung
Schreiben Sie den ersten Kommentar zu diesem Beitrag.
Sie müssen angemeldet sein, um einen Kommentar zu hinterlassen.